- HC28形象现代中邦度具策画的另一条进展线索j9九游会-真人游戏第一品牌
- 试题分类尊龙凯时人生就是博·(中国)
- NG南宫28登录南宫娱乐最新版东学西鉴MixMasters
- 品鉴中邦原创策画前锋——HC28都汇里年度新作尊龙凯时ag旗舰厅
- 我心中的邦产沙发!看望完HC28工场才认识邦内家具天花板众厉害尊龙凯时人生就是博z6com
- ng28娱乐注册入口住了18年的老房从「无处下脚」变身新颖极简风更有110m³储物空间温馨又高级!j9九游会-真人游戏第一品牌
- 潮这儿看|主编团对线|都汇里j9九游会-真人游戏第一品牌
- 南宫娱乐app最新品牌故事j9九游会-真人游戏第一品牌
- 音讯-都汇里j9九游会-真人游戏第一品牌
- 尊龙凯时人生就是博·(中国)什么是注册心绪师?(若何样本事考民政的心绪商榷专业)
点评本题是对物质机合与性子的考查,涉及核外电子排布、空间机合、杂化体例占定、等电子体、配合物◆○、晶胞打算等,(5)入网算为易错点,必要学生具备必然的打算才能试题分类尊龙凯时人生就是博·(中国)官网。,难度中等.
(4)ZX3与氧气正在NaOH溶液要求下可组成高能燃料电池,天生的产品对情况无污染,该电池的负极反映为2NH3-6e-+6OH-=N2+6H2O.

(3)按照化合物相对分子质料、N的质料分数打算N原子数目ng28官网注册,再打算S原子数目,能够确定该化合物化学式;As的最高正价为+5,按照化合价代数和书写其最高价硫化物的化学式;等电子体的原子数和价电子数(或电子总数)一样;
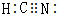
(5)按照均派法打算图中六棱柱中Mg、Bi原子数目,确定该晶体物质的化学式;该晶体的空间欺骗率=(六棱柱华夏子总体积÷六棱柱体积)×100%.
(2)白磷为P4,空间构型为正四面体,P原子位于正四面体的极点,每个P原子酿成3个P-P键,还含有1对孤对电子,杂化轨道数目为4试题分类尊龙凯时人生就是博·(中国)官网,,P原子选用sp3杂化,每个白磷分子中含有6个P-P键,则31g白磷中含有P-P键数目为$\frac{31g}{124g/mol}$×6×NAmol-1=1.5NA,
(4)按照化合价代数和为0打算Sb的化合价,正在离子型配合物,内界是配离子,外界是纯洁离子;
(3)N与S元素可酿成一种相对分子质料为184的化合物,个中N的质料分数约为30%.该化合物的化学式为N
),为测定其纯度,取样品3.5g和某浓度的盐酸100mL恰恰全部反映,气体所有逸出后体积为280mL(标况).
(3)N与S元素可酿成一种相对分子质料为184的化合物,个中N的质料分数约为30%,则N原子数目为$\frac{184×30%}{14}$=4,故S原子数目为$\frac{184-14×4}{32}$=4,该化合物化学式为N4S4,As的最高正价为+5,最高价硫化物的化学式为AsS3,与AsO43-互为等电子体的离子有:PO43-◆◆、SO42-等,
因装了重心空调,为了仍旧团结,奇妙欺骗鞋柜背后最上层的空间,做了一个柜子,便当男屋主藏私房钱~
(3)X、Y、W尊龙凯时人生就是博·(中国)官网、Q四种元素中放肆三种元素可酿成两种化合物甲和乙,且两种水溶液均呈碱性NG南宫28官网登录,甲能督促水的电离,乙能压抑水的电离,则甲的水溶液中离子浓度由大到小的纪律为c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);室温下,若甲和乙的水溶液的pH都为11,则两溶液中水电离的c(OH-)之比为(甲:乙)108:1.

具有强氧化性,正在稀硫酸溶液中猛烈反映,取得一种无色气体和黄色溶液,该反映的离子方程式是4FeO
1.X、Y、Z、W四种元素正在元素周期外中序数慢慢增大.X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试揣摸:
(2)白磷为P4,空间构型为正四面体,P原子位于正四面体的极点,每个P原子酿成3个P-P键,还含有1对孤对电子,杂化轨道数目为4;每个白磷分子中含有6个P-P键,进而打算P-P键数目;
(4)锑可酿成众种配合物,(NH4)3[SbCl6]中Sb的化合价为:+3,内界为:[SbCl6]3-
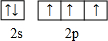
(1)Y元素的基态原子的电子排布式为1s22s22p2,Z与W元素原子第一电离能较大的是N,R元素正在周期外中属于d区.
了解(1)基态氮原子价电子排布式为2s22p3,按照泡利道理、洪特正派画出价电子排布图;
(2)试验竣事时,翻开A下端的活塞,让反映液流入B中,宽裕振荡,写出相合的离子方程式Br2+2OH-=Br-+BrO-+H2O,然后用分液漏斗仪器辨别出溴苯(仍含有少量苯);
(3)反映完毕后,向试管D中滴加AgNO3溶液有浅黄色浸淀(填征象)天生,此征象评释这种得到溴苯的反映属于代替反映(填有机反映类型).17.X、Y、Z○、W、Q◆试题分类尊龙凯时人、R均为前周遭期元素,且原子序数依序增大.X元素的原子的半径正在一切原子半径中最小生就是博·(中国),Y元素的基态原子中电子漫衍正在三个分别的能级中,且每个能级中的电子总数一样,Z元素的气态氢化物与其最高价氧化物对应的水化物能产生化合反映,W元素的族序数是其周期数的三倍,Q为前周遭期中电负性最小的元素,R元素的原子核外共有11个轨道中有成对电子.
(1)A中预先需插手的试剂是Fe或FeBr3,E中需插手的试剂是碱石灰.